Статистическая термодинамика идеального
газа.
Сумма по состояниям системы молекул в газовой фазе будет
равна:
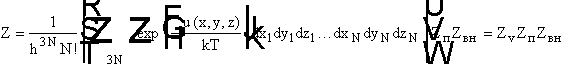
Zv -
конфигурационный интеграл, отвечающий взаимодействиям между молекулами. Если
u(x,y,z) = 0, то Zv = VN. Для расчета свойств идеального
газа надо определить ZпZвн. Для реального газа в
термодинамические функции добавится член, связанный с расчетом Zv.
Здесь важно, что только Zv зависит от объема системы. Т.к. давление
определяется как производная свободной энергии по объему: ![]() , то для вывода уравнения состояния надо знать Zv.
Для идеального газа это V и получаем уравнение состояния: p = kT/ v. Если N!
включить в конфигурационный интеграл, то поступательная и суммы внутренних
степеней свободы:
, то для вывода уравнения состояния надо знать Zv.
Для идеального газа это V и получаем уравнение состояния: p = kT/ v. Если N!
включить в конфигурационный интеграл, то поступательная и суммы внутренних
степеней свободы: 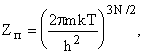
![]() и
и ![]() В данном случае делить
на N! не надо (атомы не переходят из молекулы в молекулу). Здесь n - число
атомов.
В данном случае делить
на N! не надо (атомы не переходят из молекулы в молекулу). Здесь n - число
атомов.
При вычислении термодинамических функций принимаем основной постулат, что энергии различных
видов движения независимы: энергии суммируются, суммы перемножаются. В обычных
условиях химических реакций ядерные суммы сокращаются. Электронные обычно
равны 1 или выроженности основного уровня. В каждой молекуле 3 поступательные
степени свободы (кроме адсорбции), 3 или 2 у линейных молекул степени свободы
вращения, 3m - 6 или 3m - 5 степеней свободы колебаний. Наличие внутреннего
вращения уменьшает колебания (колебание не имеет конечной амплитуды и переходит
во вращение). Соответственно для расчета термодинамических функций надо сложить
полученные ранее выражения для энергии отдельных видов движения в молекуле.
В качестве примеров:
Стандартная энтропия азота по расчету 45,79 э.е., калориметрические опыты -
45,77 э.е. кислород: 49,03(р) и 49,01(о). Для СО разница: 47,3(р) и 46,2(о). Для водорода 31,22(р) и 29,6(о).
Дело в точ, что в пренебрежении взаимной ориентацией молекул для СО и спиновыми
характеристиками для Н2.
Для расчета химического равновесия надо получить
выражение для химического потенциала. Из классической термодинамики (ni -
мольная доля).
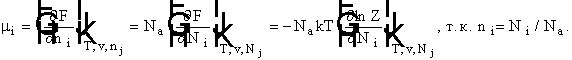
Для идеального газа и
смеси идеальных газов из Ni молекул
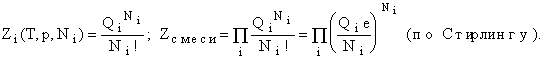
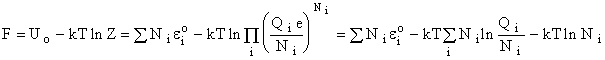 и
и
![]() где
где ![]()
Условие равновесия -
равенство химических потенциалов реагентов и продуктов
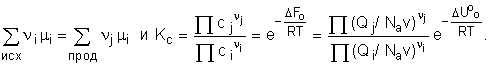
Т.к. Z пост =
f(v), то в окончательном выражении объем сокращается.
Используя соотношение
между Кр и Кс, введем стандартную сумму ![]() и
и ![]() Для расчета равновесия
надо знать разницу нулевых уровней энергии и уметь считать отдельные суммы по
состояниям. Знаем соотношения
Для расчета равновесия
надо знать разницу нулевых уровней энергии и уметь считать отдельные суммы по
состояниям. Знаем соотношения
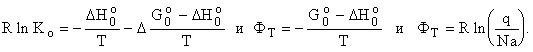 Термодинамический
потенциал ФТ чаще приводят в таблицах вместе с энтропией (слабо
зависит от Т).
Термодинамический
потенциал ФТ чаще приводят в таблицах вместе с энтропией (слабо
зависит от Т).
В реакции ![]() изменение свободной энергии
изменение свободной энергии![]() =
=
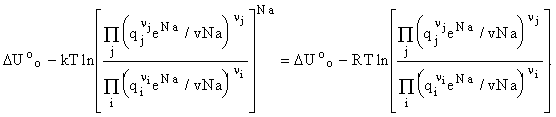
Особенность статистических расчетов равновесий -
использование Uoo - свободная энергия системы при
стандартном давлении и 1 атм. Не надо считать изменение внутренней энергии
при заданной температуре и использовать Сv.
Безусловно статистические расчеты за счет сделанных
допущений для упрощения расчетов будут скорее оценочны. Используют их
- при анализе равновесий
нестойких соединений, свойст АК в кинетике,
- в области высоких
температур, когда нет надежной термодинамической информации,
- для оценки влияния
структуры и изотопного состава молекул на протекание реакции,
- при построении теорий
химической кинетики, ТАК, РРКМ.
Вернемся к орто-пара превращению водорода. Было показано,
что при температурах выше характеристической отношение произведений ядерной и
вращательной сумм по состояниям орто-формы к пара равно 3, а при низких
температурах стремится к нулю. Поскольку все остальные суммы по состояниям
можно считать равными, константа равновесия определяется отношением
ядерных и вращательных сумм. Действительно при высоких температурах ( выше 85
К) было найдено значение константы равновесия равное 3 (преобладает
орто-форма), а при низких температурах преобладал пара-водород.
Рассмотрим реакцию изотопного обмена АХ + ВХ* = AX* + BX. Изменения числа молей не
происходит, поэтому Kc =Kp =KN = K. Тогда 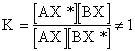 , введем
, введем 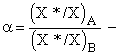 атомная доля изотопа.
Легко получить соотношения:
атомная доля изотопа.
Легко получить соотношения:
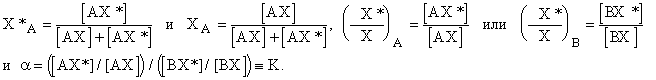 Константа равновесия - коэффициент разделения. Практически
важные примеры:
Константа равновесия - коэффициент разделения. Практически
важные примеры: ![]() ,
, ![]()
Получение реактивов
обогащенных определенным изотопом.
Ядерные и электронные
суммы по состояниям для изотопов будут равны.
Считать полностью суммы не
обязательно. Отношение сумм по состояниям равно
поступательных (qi*/qi
)пост = (m i */m i)3/2,
вращательных (qi*/qi)вращ
= (Ii*s i/ Iisi*),
колебательных (qi*/qi
) кол =[(1-exp(-ui))/(1-exp(-ui*))], ui = hn / kT.
DUoo = UooAX*
+ UooBX - UooAX
- UooBX* =
( UooAX* - UooAX
) - (UooBX* - UooBX).
Тогда коэффициент
разделения или величина a считается по формуле
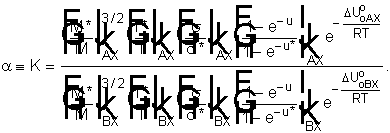
Можно принять Uoo
= hn
/ 2 и тогда
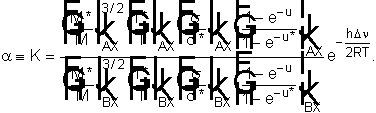
Если рассмотреть реакции изотопного водорода и дейтерия с
образованием HD, то посмотрим какие составляющие будет давать разницу в
константе равновесия. Отношение масс молекул HD к массе дейтерия или водорода даст примерно 1.
Межатомные расстояния во всех молекулах 0,74 Е, моменты инерции могут
изменится как отношение приведенных масс, для линейных молекул I = MAMB/
(Ma+MB), I = mro2. Здесь отличие невелико. Колебательные суммы примерно равны 1:
частоты 4415 для Н2, 3825 для HD, 3124 см-1 для D2-
все частоты больше 1000 см-1.
Но разница в частотах будет заметна при анализе экспоненты,
связанной с нулевой энергией - туда включили энергию нулевых колебательных
уровней, и при 300 К это даст заметный вклад. Основной вклад от отношения масс,
чисел симметрии, соотношения моментов инерции и экспоненты. Но в целом
величина близкая к 1. Для реакций обмена водорода и дейтерия в сложных
молекулах поступательные, вращательные
и колебательные составляющие будут примерно одинаковы.