Дефекты кристаллической
структуры
В
реальных кристаллах могут быть неравновесные дефекты роста. Но термодинамика
показывает, что и в равновесном кристалле должны быть дефекты.
Так
в ионных кристаллах за счет теплового движения ионы могут покидать равновесное
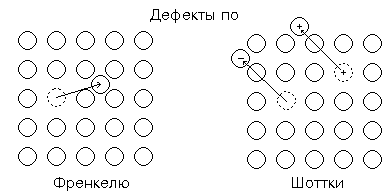
положение. Возникают точечные дефекты ( 0-мерные): дырка и ион в не обычном положении.
Дефект по Френкелю перемещение иона в междуузельное положение. Внерешеточные
ионы в объеме движутся, могут рекомбинировать с дырками. При образовании
дефектов по Френкелю чаще уходят менее прочно связанные ионы (в галогенидах
серебра ионы Ag). При этом надо принимать во внимание геометрию пространства.
Легче такие дефекты образуются при значительном различии в размерах ионов:
маленький катион, достаточно легко помещающийся между большими анионами. Дефекты по Шоттки: образуются
катионная и анионная вакансии (NaCl). Зарождение вакансий начинается на
поверхности, а затем их диффузия в объем. У ОП неточно: один ион. Но строго
дефект Шоттки: два иона наружу. Выход одного иона мало вероятен из-за
возникновения при этом нескомпенсированного заряда в объеме. Могут быть
одновременно и дефекты обоих типов.
При
образовании дефекта Шоттки
практически не будет изменения параметра решетки, но может быть
заметно изменение объема VT/ V0 = (N+Nш)/ N
(на опыте замечают удлиннение образца). Так для кристаллического ксенона
отношение объема при температуре плавления к объему при абсолютном нуле равно
1,107. Но обычно этим пренебрегают. Образование дефекта по Френкелю почти не изменит объем кристалла. Теперь
очевидно, что энергия решетки E = SEo + Eкол + Е разупор.
Расчет числа дефектов.
Дефекты по Френкелю (катионные вакансии). Примем обозначения: N - число правильных мест
катионов (всего частиц в AgHal 2N), N'
- число доступных вакансий,
NF - число дефектов по Френкелю, gF
- свободная энергия дефекта.
1-е допущение:
Примем постоянными температуру, давление и объем кристалла ( хотя объем должен
меняться, поскольку должны меняться параметры решетки, но это изменение обычно
мало).
2-е допущение:
Считаем, что образование дефекта - процесс независимый от образования других.
При этом для дефекта gF = uF - TsF. Тогда для
системы GF = NF.gF. Особенность кристалла:
упорядоченность и образование дефекта может произойти разными способами.
Число способов размещения (N - N F) катионов и N F
вакансий по N узлам равно N! / [N F! (N - N F)!] и
соответственно N F катионов по N' междуузлиям равно N'!
/ [N F! (N' - NF)!]. Состояния рекомбинируют и общее число способов
находим перемножением.
Число
способов связано с S и конфигурационнуя энтропию 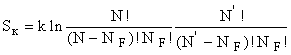 и т.к. NF
<< N, то N - NF >>
1, то
и т.к. NF
<< N, то N - NF >>
1, то ![]() . Считая N = N' , S к,макс будет при N F
= 0,5 N и равна 2k.ln(0,5) = 11,52 Дж/моль.К. Но очевидно, что вывод верен,
если число дефектов мало. В идеальном кристалла дефектов нет и Sконф
= 0. При высоких Т может быть вклад в энтропию порядка 1 э.е.
. Считая N = N' , S к,макс будет при N F
= 0,5 N и равна 2k.ln(0,5) = 11,52 Дж/моль.К. Но очевидно, что вывод верен,
если число дефектов мало. В идеальном кристалла дефектов нет и Sконф
= 0. При высоких Т может быть вклад в энтропию порядка 1 э.е. 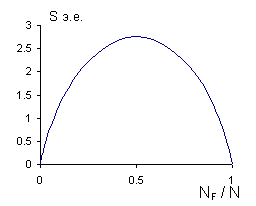
Изменение
энергии при образовании дефектов равно
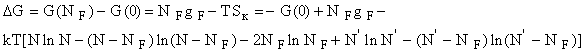 и поскольку
равновесному значению дефектов соответствует минимум G
и поскольку
равновесному значению дефектов соответствует минимум G
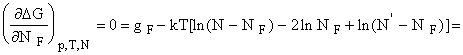
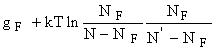 . Отсюда, считая NF << N и N’ ,
получим важное соотношение:
. Отсюда, считая NF << N и N’ ,
получим важное соотношение: ![]() Определяя в опытах
число дефектов, можем расчитать константу равновесия и следовательно
свободную энергию, а по температурной зависимости
Определяя в опытах
число дефектов, можем расчитать константу равновесия и следовательно
свободную энергию, а по температурной зависимости 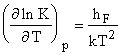 - энтальпию (hF)
и энтропию образования дефектов.
- энтальпию (hF)
и энтропию образования дефектов.
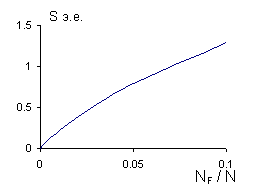
Как
показывают опыты и расчеты, число дефектов при не очень высоких температурах
также не велико, поэтому можно пренебречь изменением энтропии кристалла, мал
вклад и конфигурационной энтропии.
Изменение
энтропии связано с изменением колебательных сумм по состояниям: DsF / k » f, где f связана с отношением колебательных сумм по состояниям кристалла
(без члена, связанного с нулевым уровнем):
f = (q’ / q)n, где n - координационное число или
число типов колебаний.
Так
как температура образования заметного количества деффектов обычно велика,
то после разложения экспоненты в ряд в первом приближении f = (n/ n‘ ) n,
где n и n‘ -частоты
колебаний в идеальном и дефектном криcталлах. Изменение частот может быть достаточно
заметным: в германии и теллуре, например, почти в два раза (1,9 и 1,7)
уменьшается частота колебаний вблизи вакансии. Но в сульфиде свинца вакансия
серы увеличивает, а свинца уменьшает частоту колебания. Т.е. пренебрежение
изменением энтропии в смешанных кристаллах, как правило, даст небольшую
ошибку. Тогда считаем gF » EF.
И дефект по Френкелю: NF = (NN')1/2
exp(-EF/ 2kT).
Для образования дефектов по Шоттки число
вакансий каждого типа определяется аналогичным образом: NS = N
exp(-ES/ 2kT), ES - энергия образования пары.
Так для NaCl (500 оС): энергия образования
дефекта одно заряда
ES/ 2 = 0.5(E+ + E -
- E2i) = 0,5(4,62 + 5,18 - 7,94) = 0,93 эВ. E+ -
энергия удаления +, а Е - - удаления -, Е2i - энергия решетки, отнесенная к паре
ионов.
Дефектов
обычно мало, так энергия вакансии в меди » 1 эВ, межузельного катиона 3 эВ и при температуре
около 1000 К вакансий будет около 10 - 4, междуузельных
1.10 -11. Для сравнения энергия тепловых колебаний 0,12 эВ.
|
|
Cu E = |
110 кДж/ моль |
SrF2 E = |
61,75 кДж/ моль |
|
|
Nвак / N |
S конф. э. е. |
Nвак / N |
S конф. э. е. |
|
T = 500 K |
1,79.10 - 6 |
1.10 - 4 |
6.10 - 4 |
0,02 |
|
T = 1000 K |
1,34.10 - 3 |
0,04 |
0,024 |
0,46 |
Но важна роль этих состояний в химии поверхности,
катализе. Число дефектов определяет
ионную проводимость. На поверхности 1015 центров/ см2,
т.е. доля центров-дефектов на поверхности может быть достаточно большой.
Помимо
этого возможно образование нестехиометрических соединений за счет равновесия
тверого тела с паром. Так оксид титана обедняется кислородом и получаем формулу
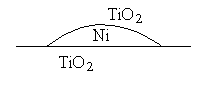
TiO2 - x . Проблема дальтонидов и беротоллидов. На поверхности
возможна миграция атомов и молекцул. Например на поверхность кластера никеля,
образованного на поверхности оксида титана выходят молекулы TiO2.
Кооперативные явления
Если
решетка состоит из частиц А и В (но не ионов), то в равновсеном состоянии
возможны различные расположения частиц в решетке (конечно при синтезе можно
получить и неравновесную стуктуру):
случайное чередование домены
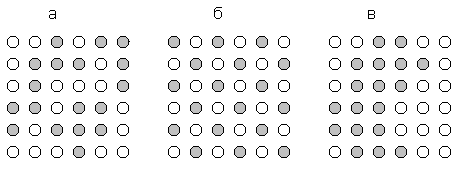
Если энергии парных взаимодействий А-В, А-А и В-В одинаковы, то будет случай-ное расположение
(а). Если А-В более выгодно, то будет суперструктура (б). Собственно случай
ионных кристаллов. Такую структуру система имеет при Т = 0, а выше будут
тепловые дефекты. Образуются как бы две подрешетки. Если взаимодействия А - А и
В - В более выгодны, чем А - В реализуется случай (в). Структура выделения. Система
будет при понижении Т легко расслаиваться. Обычно существуют структуры (б) -
CuZn, антиферромагнетики: противоположная ориентация спинов, и (в) - ферромагнетики: параллельная ориентация
спинов. Такие процессы образования определенной ориентации называют
кооперативными явлениями. Используют при рассмотрении свойств и поведения
сплавов, адсорбции, катализа, полимеризации.
Для
оценки термодинамической вероятности определенного типа структуры рассмотрим
энергию взаимодействия U = NAAuAA + NBBuBB
+ NABuAB. Введем
w = uAB - 0,5(uAA+uBB) - энергию
взаимообмена. Если
w < 0 (т.е. uAB < uAA+uBB),
то выгодно образование смешанных пар (А-В). Если w > 0, то выгодно образование пар А-А и В-В. Сумма по состояниям cистемы (поскольку
колебания атомов А и В считаем независимыми от соседей) равна Z = Zкол Zконф
= ![]() . Ui - потенциальная энергия системы в i -
конфигурации. От конфигурации будет зависить и энтропия системы. Решается
достаточно просто для одномерных кристаллов, уже двумерные структуры
анализировать сложно.
. Ui - потенциальная энергия системы в i -
конфигурации. От конфигурации будет зависить и энтропия системы. Решается
достаточно просто для одномерных кристаллов, уже двумерные структуры
анализировать сложно.
Изотермы адсорбции.
Рассмотрим
адсорбционный процесс ![]() . Такое равновесие дает нам ограничения модели: молекула
адсорбируется только на свободных центрах So и занимает при этом 1
центр, адсорбция мономолекулярна и нет поверхностной подвижности. Константа
адсорбционного равновесия K = ca / (cg cs ),
где ca = Na / S - число адсорбированных на единице
поверхности (S) молекул, cg = Ng
/ V - число молекул в единице объема, cs = Ns / S - число
свободных центров поверхности. Выражая константу равновесия через суммы по
состояниям, получим
. Такое равновесие дает нам ограничения модели: молекула
адсорбируется только на свободных центрах So и занимает при этом 1
центр, адсорбция мономолекулярна и нет поверхностной подвижности. Константа
адсорбционного равновесия K = ca / (cg cs ),
где ca = Na / S - число адсорбированных на единице
поверхности (S) молекул, cg = Ng
/ V - число молекул в единице объема, cs = Ns / S - число
свободных центров поверхности. Выражая константу равновесия через суммы по
состояниям, получим 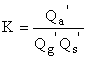 , где Qi’
- полные суммы по состояниям. Если исключить энергии нулевых колебаний и
отнести сумму по состояниям газа к единице объема, то получим выражение для константы
равновесия адсорбции
, где Qi’
- полные суммы по состояниям. Если исключить энергии нулевых колебаний и
отнести сумму по состояниям газа к единице объема, то получим выражение для константы
равновесия адсорбции ![]() , где qS - QS / V и l - теплота адсорбции. Будем считать
газ идеальным, тогда p = kTcg, а сумммы по состояниям твердого тела
обычно близки единице. Тогда получаем выражение
, где qS - QS / V и l - теплота адсорбции. Будем считать
газ идеальным, тогда p = kTcg, а сумммы по состояниям твердого тела
обычно близки единице. Тогда получаем выражение ![]() Введем степень
заполнения
Q. При одноцентровой адсорбции в монослое ca
= ca,максQ,
Введем степень
заполнения
Q. При одноцентровой адсорбции в монослое ca
= ca,максQ,
сs = ca,макс - ca.
Отсюда ca / cs = Q
/ (1 - Q) и путем
простых преобразований
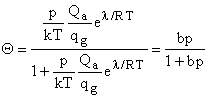 , где
, где![]() и
и ![]() Это выражение можно
упростить: при локализованной адсорбции молекула теряет одну поступательную степень свободы, которая заменяется на колебание
относительно поверхности. Тогда, полагая все остальные суммы по состояниям
одинаковыми, получим
Это выражение можно
упростить: при локализованной адсорбции молекула теряет одну поступательную степень свободы, которая заменяется на колебание
относительно поверхности. Тогда, полагая все остальные суммы по состояниям
одинаковыми, получим ![]()
Теперь, поскольку обычно hn/ kT мала, разлагаем экспоненту в ряд и определим
![]() В области малых
заполнений bp < 1 и изотерма Лэнгмюра переходит в изотерму Генири:
В области малых
заполнений bp < 1 и изотерма Лэнгмюра переходит в изотерму Генири: ![]() Теперь допустим, что
любая налетающая на поверхность молекула адсорбируется. Тогда количество
адсорбированных молекул на единице поверхности будет равно s = n
t (формула Де-Бура), где n - среднее число налетающих
на единицу поверх-ности в единицу времени молекул, t - среднее время жизни молекулы на поверхности. Величину n можем
выразить из закона распределения молекул по скоростям Максвелла-Больцмана,
согласно которому
Теперь допустим, что
любая налетающая на поверхность молекула адсорбируется. Тогда количество
адсорбированных молекул на единице поверхности будет равно s = n
t (формула Де-Бура), где n - среднее число налетающих
на единицу поверх-ности в единицу времени молекул, t - среднее время жизни молекулы на поверхности. Величину n можем
выразить из закона распределения молекул по скоростям Максвелла-Больцмана,
согласно которому
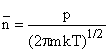 . Формула Герца - Кнудсена. Из сопоставления видно, что
среднее время жизни молекулы на поверхности
. Формула Герца - Кнудсена. Из сопоставления видно, что
среднее время жизни молекулы на поверхности ![]() Т.е. имеет порядок
частоты колебания, что и понятно, т.к. если энергия связи с поверхностью равна
нулю, то колебание сразу приводит к десорбции. Т.е. получили формулу Френкеля: t = toexp(l/ RT). Для нелокализованной адсорбции to » 10 -16 c. При теплоте адсорбции 10 ккал/
моль время жизни молекулы на поверхности составляет 2,88.10 -6 с, а
при 20 ккал/ моль уже 83 с. При хемосорбции время жизни резко возрастает. Так
при 30 ккал/ моль молекула удерживается на поверхности в течении 2,39.109
c или 75,8 лет - можно дождаться. А теплота адсорбции кислорода на вольфраме
равна 147 ккал/ моль и время жизни молекулы на поверхности составит 4,54.1096
с или 1087 столетий. Для поверхностной подвижности Френкелем
предложена аналогичная формула t ' = to' exp(l' / RT). l' - теплота поверхностной подвижности 1/ 3
теплоты адсорбции. Эти соотношения важны для понимания механизмов гетерогенного
катализа.
Т.е. имеет порядок
частоты колебания, что и понятно, т.к. если энергия связи с поверхностью равна
нулю, то колебание сразу приводит к десорбции. Т.е. получили формулу Френкеля: t = toexp(l/ RT). Для нелокализованной адсорбции to » 10 -16 c. При теплоте адсорбции 10 ккал/
моль время жизни молекулы на поверхности составляет 2,88.10 -6 с, а
при 20 ккал/ моль уже 83 с. При хемосорбции время жизни резко возрастает. Так
при 30 ккал/ моль молекула удерживается на поверхности в течении 2,39.109
c или 75,8 лет - можно дождаться. А теплота адсорбции кислорода на вольфраме
равна 147 ккал/ моль и время жизни молекулы на поверхности составит 4,54.1096
с или 1087 столетий. Для поверхностной подвижности Френкелем
предложена аналогичная формула t ' = to' exp(l' / RT). l' - теплота поверхностной подвижности 1/ 3
теплоты адсорбции. Эти соотношения важны для понимания механизмов гетерогенного
катализа.