Жидкости
Основные состояния вещества в химии: газы, жидкости и твердые тела. Плазма - особая химия. Жидкости и твердые объединяют в конденсированные фазы. Различие: в твердых телах движение частиц ограничено (колебания около положения равновесия). В кристаллах существует ближний и дальний порядок расположения. В жидкости - только ближний и частицы движутся по всему объему.
Энергия взаимодействия частиц в жидкости меньше, чем в кристале, но полная энергия и энтропия в жидкости больше. Но по физическим свойствам, особенно вблизи точки плавления, жидкости и твердые во многом совпадают. Например для воды:
вода 1,5 оС лед
r первой сферы, Е 2,90 2,76
r второй сферы, Е 4,50 4,51
коорд. число 4,4 4
Ближний порядок - жидкость можно рассматривать как совокупность микрокристаллов. Есть жидкости, в которых и ближний порядок отличается от твердого, но можно говорить все-таки об упорядоченности частиц - вводится понятие ячеек. Это результат того, что в жидкостях расстояния между молекулами много меньше длины свободного пробега, который можно посчитать из тепловой энергии. Поскольку жидкости менее плотные, то амплитуда колебаний в них больше, чем в кристалле (нельзя применять модель малых колебаний). Первоначально анализ свойств жидкости основывался на представлениях Ван-дер-Ваальса: жидкость - безструктурная среда. В 30 - х годах от этого отказались и развиваются теории, предполагающие наличие ближнего порядка. Теория ячеек или свободного объема (Эйринг), дополненная позднее учетом возможности образования дырок (вакансий) в более или менее упорядоченной среде (Кирквуд). Аналогичные представления использованы Арановичем для описания свойств адсорбированного слоя. Другой подход - используют аппарат, основанный на задании функции распределения частиц по объему. В последнее время стали применять методы Монте-Карло и молекулярной динамики.
Теория ячеек или свободного объема.
Здесь жидкость рассматриваем как
совокупность ячеек небольшого объема, в центре которых расположена одна
частица, а соседние образуют стенки такой ячейки. Сразу очевидны недостатки:
пренебрегаем связью движения молекул в соседних ячейках, свободный обмен между
ячейками исключается (будут ошибки в энтропии). Простейшая модель изображена ниже: частица в
центре имеет c соседей.
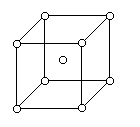
Но не обязательно именно такое расположение (главное: на стенках закрепленные молекулы). Очевидно, что модель применима вблизи температуры плавления.
В наиболее простом варианте жидкость из N частиц рассматривается как совокупность N одинаковых ячеек (т.е. нет флуктуаций свойств). Усовершенствование теории: предположение о том, что число ячеек больше N, т.е. часть ячеек пустые - вакансии.
Конфигурационный интеграл для жидкости будет иметь вид
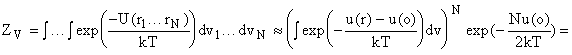
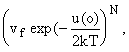 где vf -
конфигурационный интеграл для ячейки объемом, равным vi = V/ N, где V - общий объем, u(r) -
энергия на расстоянии r от центральной частицы, u(o) - энергия частицы в
центре ячейки. На 2 делим, чтобы не учитывать частицу дважды. Если сможем
задать конфигурационный интеграл (свободный объем), то можем рассчитать
термодинамические свойства.
где vf -
конфигурационный интеграл для ячейки объемом, равным vi = V/ N, где V - общий объем, u(r) -
энергия на расстоянии r от центральной частицы, u(o) - энергия частицы в
центре ячейки. На 2 делим, чтобы не учитывать частицу дважды. Если сможем
задать конфигурационный интеграл (свободный объем), то можем рассчитать
термодинамические свойства.
Fv = N u(о)/ 2 - NkT ln(v f ).
Uv = Nu(о)/ 2 + NkT2(d ln(v f )/ dT).
S = Nk lnv f +Nk T(dln(v f )/ dT). Возможен расчет для потенциала 6 - 12.
Рассмотрим
частицу в сферической ячейке, у которой
все остальные частицы закреплены (на cтенке), одна подвижна. Все ячейки
одинаковы. Молекул в ячейке всего
c + 1. Тогда расстояния до соседей
(r £ a):

Предел
смещения по r от 0 до a. Расстояние а можно рассматривать как квази параметр
решетки жидкости. Потенциал 6-12 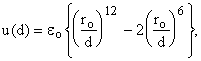 где ro
- расстояние, соответствующее минимуму потенциальной энергии
взаимодействия eo. Удобно выразить энергию
как функцию одной переменной - r.
Находим среднюю энергию u(d) при
заданном значении r. Для этого усредняем энергию взаимодействия по всем
углам от 0 до p при
постоянном r.
где ro
- расстояние, соответствующее минимуму потенциальной энергии
взаимодействия eo. Удобно выразить энергию
как функцию одной переменной - r.
Находим среднюю энергию u(d) при
заданном значении r. Для этого усредняем энергию взаимодействия по всем
углам от 0 до p при
постоянном r. 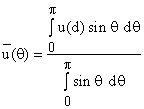 . Здесь
знаменатель
. Здесь
знаменатель 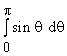 равен 1/ 2. (для переменной
x = cos q получим табличный интеграл
равен 1/ 2. (для переменной
x = cos q получим табличный интеграл
(- d(cos q) = sinq dq ). При заданных пределах получаем cos 0 = 1, cosp = - 1.)
Подставим
уравнение для потенциала, в котором d выражаем через a, r и cos q : 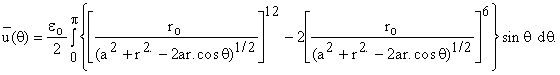
В результате интегрирования получаем:
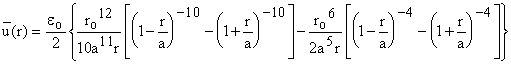 .
.
Введем
безразмерную переменную смещения y = r2 / a2, что дает: ![]()
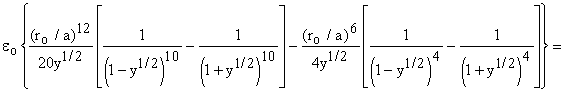
(и после
вынесения знаменателей в каждом слагаемом получаем)
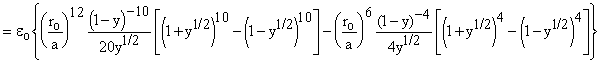 .
.
При возведении в степень во вторых слагаемых в квадратных скобках нечетные члены будут со знаком минус и сократятся соответствующими членами в первых слагаемых. Тогда в каждой квадратной скобке получаем:
для 1-й: 1+12y +25,2y2 + 12y3 +y4 и для 2-й: 1 + y.
Для удобства последующих вычислений введем новые функции, вычитая единицу:
![]() Тогда
Тогда
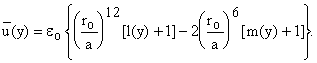 Понятно условие: при y
= 0 функции m и l также равны нулю. Теперь можно считать нужную нам величину v f.
Сначала меняем а. Найдем энергию в центре ячейки (при d = a, т.е. при r = 0).
Понятно условие: при y
= 0 функции m и l также равны нулю. Теперь можно считать нужную нам величину v f.
Сначала меняем а. Найдем энергию в центре ячейки (при d = a, т.е. при r = 0).
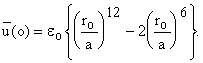 Тогда разность
энергий в какой либо точке и в центре
Тогда разность
энергий в какой либо точке и в центре
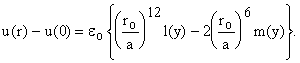 Это удобно для вычисления v f .
Это удобно для вычисления v f .
Пусть молекула имеет c соседей на стенках, тогда общая энергия в c раз больше (принимаем аддитивность). Энергия молекулы в ячейке при заданном r будет равна
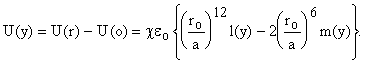 (Это объясняет
зачем, вводя l(y) и m(y), добавляли (- 1) - для получения формулы в таком
виде.)
(Это объясняет
зачем, вводя l(y) и m(y), добавляли (- 1) - для получения формулы в таком
виде.)
Теперь можем вычислить свободный объем v f (конфигурационный интеграл). Т.к.
r = ay1/ 2, то dr = ay- 1/ 2 dy/ 2. r2dr = a3y1/2d(y/ 2). Объем моделируем сферой радиусом r и dv = 4pr2dr. Для сферы rмакс = a/ 2. Предел 1/ 4 потому, что y1/ 2макс = 1/ 2.
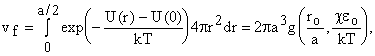 где
где 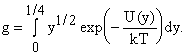
Ввели
функцию g(ro/ a, ceo
/ kT). Функция g считается численно, есть таблицы. Т.к. величина
a3 пропорциональна v, то можем написать v f как ![]() .
.
Уравнение состояния (по приемам всех вычислений) будет
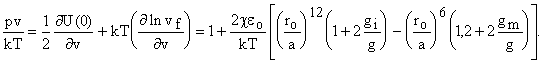
Снова ввели новые вспомогательные функции
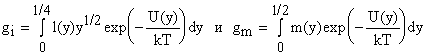 . Функции gi и gm математически
похожи на g и также есть таблицы для разных ro / a и
ceo / kT.
. Функции gi и gm математически
похожи на g и также есть таблицы для разных ro / a и
ceo / kT.
Для расчета надо знать среднее
расстояние между молекулами в жидкости, координационное число, ro
и eo.
Изотерма p = f(V)имеет S - образный вид при температурах ниже Ткрит, определяемой условием ceo / kTкрит = 9 (для c = 12 соседей в первом слое). Часто хорошо совпадает с опытом. Полученное уравнение позволяет неплохо считать фактор сжимаемости z = pv/ RT (так для криптона при 273 К опыт дает 2,07, а расчет 2,10) вычислить критическую температуру. Расчет приведенных критических параметров для модели ячейки при c = 12 с использованием потенциала Леннард - Джонса дает ( в скобках приведены величины, расчитанные с использованием данных опыта):
Т* кр ![]() = 1,30 (1,26), V* кр
= 1,30 (1,26), V* кр 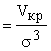 = 1,77 (3,15), Р* кр
= 1,77 (3,15), Р* кр 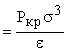 = 0,434 (0,117).
Удивительно хорошее совпадение для температуры, но плохо для давления и объема.
Аналогичные представления об образовании вакансий в жидкости были использованы
на Химическом факультете Арановичем для более строгого вывода уравнения
полимолекулярной адсорбции. Уравнение БЭТ строго физически не верно: расходящийся
интеграл Гиббса.
= 0,434 (0,117).
Удивительно хорошее совпадение для температуры, но плохо для давления и объема.
Аналогичные представления об образовании вакансий в жидкости были использованы
на Химическом факультете Арановичем для более строгого вывода уравнения
полимолекулярной адсорбции. Уравнение БЭТ строго физически не верно: расходящийся
интеграл Гиббса.
Но, поскольку введение ячейки накладывает ограничение на движение молекул, вычисленная энтропия будет заметно меньше, чем опыт. В идеальном одноатомном газе сумма Z = Zвн Zv.
Z(I) для N
молекул в газе 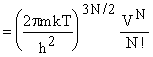 . В пределе отсутствия взаимодействия должны были бы
получить сумму для идеального газа, а в рассматриваемой модели жидкости при
u ®
0:
. В пределе отсутствия взаимодействия должны были бы
получить сумму для идеального газа, а в рассматриваемой модели жидкости при
u ®
0: 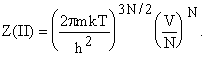 Наличие
перегородок делает частицы различимыми и N! отсутствует. Для внутренней
энергии и давления выражения, полученные с использованием этих сумм, будут одинаковыми (невзаимодействующие
молекулы), а разница в энтропии существенна
Наличие
перегородок делает частицы различимыми и N! отсутствует. Для внутренней
энергии и давления выражения, полученные с использованием этих сумм, будут одинаковыми (невзаимодействующие
молекулы), а разница в энтропии существенна ![]() ( для
сравнения: изменение энтропии плавления »
Nk). При этом переходе использовали формулу Стирлинга для больших х: ln x! =
(x + 1/ 2)ln x - x + ln(2p)/ 2. Пренебрегая ln x и p : ln x! = x lnx - x.
( для
сравнения: изменение энтропии плавления »
Nk). При этом переходе использовали формулу Стирлинга для больших х: ln x! =
(x + 1/ 2)ln x - x + ln(2p)/ 2. Пренебрегая ln x и p : ln x! = x lnx - x.
Соответственно энтропия, рассчитанная по модели ячеек, будет на Nk меньше, а свободная энергия на NkТ больше. Для согласования произвольно (ее не должно быть) вводят “коллективную энтропию”, включая в сумму Z множитель eN. Смысл - учет вариантов различных расположений молекул.
Более точно критические давление и объем позволяет вычислить теория дырок, учитывающая существование вакансий в решетке "кристаллической" жидкости - до 50 % в неассоциированной жидкости вблизи температуры кипения. Получается при этом и правильное выражение для энтропии: не надо вводить поправку.
Не обязательно использовать
только потенциал типа Леннард-Джонса. Эйринг вывел уравнение на основе
потенциала Сазерленда. В этом случае значение
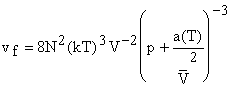 или для кубической структуры ячейки в жидкости
или для кубической структуры ячейки в жидкости 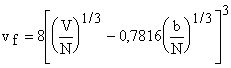 , где b = 2pNs3/
3 - учетверенный объем молекул как и в
уравнении Ван-дер-Ваальса, а множитель 0,7816 учитывает упаковку.
, где b = 2pNs3/
3 - учетверенный объем молекул как и в
уравнении Ван-дер-Ваальса, а множитель 0,7816 учитывает упаковку.
Т.к. p =
kT(dlnZ/
dv)T, то зная v f ,
определяем Z и получаем уравнение состояния
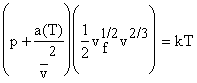 , или для
кубической (объемная кубическая даст 0,7163, гранецентрированная решетка
0,6962) упаковки
, или для
кубической (объемная кубическая даст 0,7163, гранецентрированная решетка
0,6962) упаковки 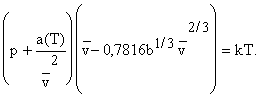
Т.е. недоступный объем есть функция от мольного объема. Если считать, что происходит перекрывание жестких сфер, то полная аналогия с уравнением Ван-дер-Ваальса. Т.е. уравнение Ван-дер-Ваальса на ветви жидкости также качественно обосновано при температурах, близких к температуре плавления.
Используя уравнение Эйринга можно обосновать правило Гилдебранда (давление насыщенного пара - универсальная функция от DHисп/RTкип) и правило Трутона: DSисп = DHисп /Ткип » 80 Дж/моль.К.
Отметим, что значение v f при постоянной Т также постоянно. Для вывода
преобразуем 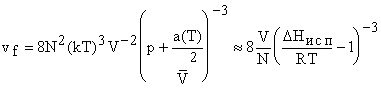 .
.
Здесь
считали p = 1 << a/ V2. (Достаточно точно.) Упрощенно приняли,
что энергия решетки раствора равна теплоте испарения при постоянном V и DUисп = a(T)/ V. Из сравнения G идеального газа и
жидкости следует p = kTexp( -
DH/ RT) / v f (правило Гильдебранда) и тогда 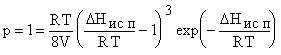 . При выводе допускается идеальность пара и pV
жидкости << pV пара. Опыты показывают, что значение RT/ 8V мало
меняется для разных жидкостей и обычно около 35 (при температуре кипения р =
1 атм). Численный анализ формулы показывает, что изменение значения RT/ 8V от
20 до 60 мало влияет на величину DH/
RT: она при этом меняется от 9,37 до 11,00. Принимают эту величину равной
10,4 (чем достигается согласие с правилом Трутона), что соответствует
значению RT/ 8V »
40. Таким образом, достаточно простая модель позволяет обосновать
эмпирическое к классической термодинамике правило.
. При выводе допускается идеальность пара и pV
жидкости << pV пара. Опыты показывают, что значение RT/ 8V мало
меняется для разных жидкостей и обычно около 35 (при температуре кипения р =
1 атм). Численный анализ формулы показывает, что изменение значения RT/ 8V от
20 до 60 мало влияет на величину DH/
RT: она при этом меняется от 9,37 до 11,00. Принимают эту величину равной
10,4 (чем достигается согласие с правилом Трутона), что соответствует
значению RT/ 8V »
40. Таким образом, достаточно простая модель позволяет обосновать
эмпирическое к классической термодинамике правило.
Растворы
Если молекулы в растворе имеют те же суммы по состояниям внутрених степеней свободы, что и в чистой жидкости (), то смесь молекул А и В при обозначениях: хA = NA/(NA+NB) - мольная доля A, v fAA, uoAA - конфигурационный интеграл и энергия взаимодействия в чистой жидкости, v fA, uoA - то же, но в растворе, то для образования одного моля раствора по сравнению с идеальным получим термодинамические функции
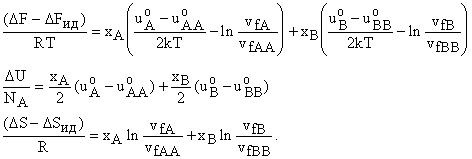
Если суммы по состояниям одинаковы и одинаковы энергии взаимодействия, т.е. и конфигурационные интегралы в растворе и чистой жидкости, то получим, что при смешении не выделяется тепло, не меняется объем, а энтропия смешения равна изменению энтпропии при образовании идеального раствора. То же будет и для свободной энергии. При этом энергии взаимодействия и конфигурационные интегралы могут быть достаточно произвольными и разными величинами для разных жидкостей. Т.е. при переходе в раствор не меняется вид потенциала взаимодействия молекул, например, Леннард-Джонса. Таким образом получили не очевидный без статистического рассмотрения результат, что законы идеальных растворов могут выполняться и при наличии взаимодействия компонентов раствора.
Регулярные
растворы
Для таких растворов теплота смешения не равна
нулю, объем не меняется, изменение энтропии равно изменению энтропии при
образовании идеального раствора. Из приведенных формул очевидно, что это может быть и при условии, что свободные
объемы примерно постоянны при переходе в раствор, а Duo
¹ 0. Почему Duo
может быть не равно нулю понятно. Энергия взаимодействия для пары молекул в потенциале
Леннард - Джонса может быть оценена как
eAB = (eA + eB)1/2. При оценке 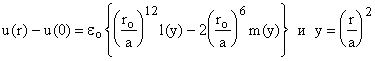 следует учесть,
что может меняться также параметр a,
т.е. и y. При этом отношение
свободных объемов может остаться » 1:
следует учесть,
что может меняться также параметр a,
т.е. и y. При этом отношение
свободных объемов может остаться » 1:  и при изменении энергии взаимодействия изменение параметра
a может не изменить значение
конфигурационного интеграла. Соблюдение условий следует из сравнения изменения
энергии и функций g.
и при изменении энергии взаимодействия изменение параметра
a может не изменить значение
конфигурационного интеграла. Соблюдение условий следует из сравнения изменения
энергии и функций g.
Атермальные (атермические) растворы.
Для них характерно отсутсутствие
теплового эффекта и изменения объема
при образовании раствора. Понятно, что это требует неизменности энергии
взаимодействия, но различия в значениях конфигурационных интегралах. Это может
быть связано с изменением расположения частиц в растворах полимеров в
мономерах. Конфигурационный интеграл и энергия взаимодействия по разному
откликаются на изменение параметров а
и e.
Общий итог: исходя из основной модели, очевидно. что теория ячеек или свободного объема может быть достаточно строгой для плотных жидкостей вблизи температуры плавления. Для умеренной плотности эта теория работает плохо.